Este é um artigo bem teórico, mas escrito de maneira simplificada por ser direcionado a quem não é expert no assunto. Resolvi escrever a respeito dele, pois não é fácil achar algo didático em português para leigos, e mais do que isso, já vi conceitos errados em blogs por aí. Apesar da minha formação como geóloga ter uma base forte em química e física, em cosmetologia não sou expert. Por isso, pedi um help para a minha mãe, que é farmacêutica e professora da UFES (Universidade Federal do Espírito Santo). Já que eu tenho a sorte de ter uma mãe que entende dos paranauês, por que não aproveitar para aprender mais e compartilhar o conhecimento com todo mundo, não é mesmo?
Tensoativos/surfactantes são substâncias responsáveis por reduzir a tensão superficial da água e de outros líquidos.
Tensão superficial é a força necessária para que um líquido se espalhe por um comprimento em uma superfície.
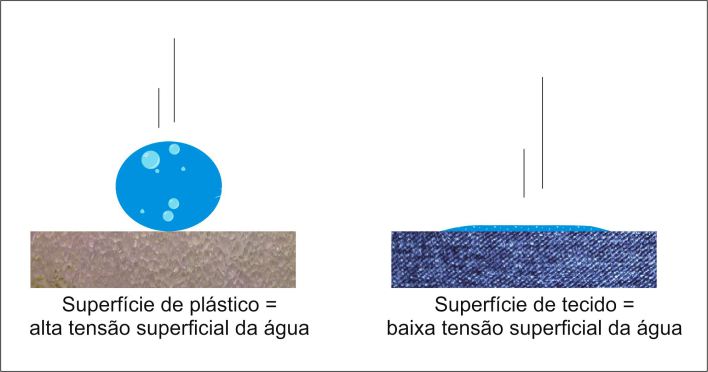
Imagine duas situações, como mostra a figura abaixo: uma gota d’água caindo sobre uma superfície de plástico e uma gota d’água caindo sobre a superfície de um tecido. No primeiro caso, a gota d’água tende a manter seu formato circular, e no segundo caso a gota tende a se espalhar. O primeiro caso retrata uma tensão superficial alta da água, e, o segundo caso, uma tensão superficial baixa. Agora, imagine uma superfície de óleo e a mesma gota d’água em contato com ela. A interação observada seria semelhante ao contato entre a gota e a superfície de plástico.
Mas o que isso tem a ver com cabelos?
Bom, quando nossos cabelos estão sujos, essa sujeira se trata basicamente de poeira do dia-a-dia e óleo, aquele produzido pelas glândulas sebáceas do couro cabeludo e pela epiderme (há também os resíduos deixados por produtos cosméticos, mas para simplificar, não vamos considerá-los, agora). Esse óleo cria uma “capa” ao redor dos fios. Se a tensão superficial da água em contato com o óleo é alta, a água não consegue molhar os cabelos e remover eficientemente o óleo. Como faremos, então, se quisermos lavá-los para diminuir a oleosidade excessiva?
Pois bem, para que a água consiga se misturar mesmo com o óleo, é necessário reduzir a sua tensão superficial. Mas como?? Adicionado tensoativos!!
Leia
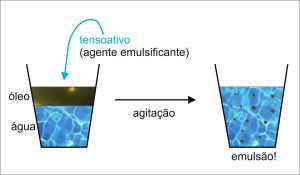
Para ficar mais fácil de entender, imagine um copo com mais água do que óleo, e nele, adicionamos um tensoativo. Depois de agitarmos essa mistura, o tensoativo faz com que o óleo se transforme em glóbulos microscópicos, dispersos na água. O produto gerado é chamado de emulsão. Agora, imagine seus cabelos encapados com óleo, debaixo do chuveiro. Você espalha o shampoo nos fios, friccionado-os (“agitando-os”!). Pois bem, o mesmo acontece, ou seja, óleo dos cabelos + água do chuveiro + tensoativos (do shampoo) = emulsão! O óleo “dissolve” na água.
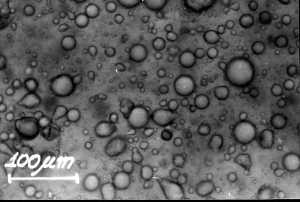
Fotomicrografia de uma emulsão real (http://www.visaoacademica.ufpr.br/v3n1/hidrofilo.htm)
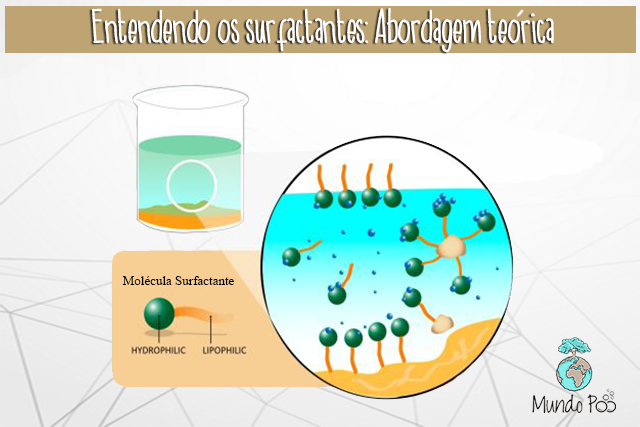
Mas como efetivamente a sujeira é removida? A figura abaixo mostra uma representação simplificada de um tensoativo. Ele possui uma cauda hidrofóbica (não gosta de água, mas gosta de óleo), que é constituída por uma cadeia de hidrocarbonetos (cadeias compostas por hidrogênio e carbono). Também possui uma cabeça hidrofílica (gosta de água, mas não gosta de óleo), composta por grupos que se ionizam em água, e hidroxilas (OH–).
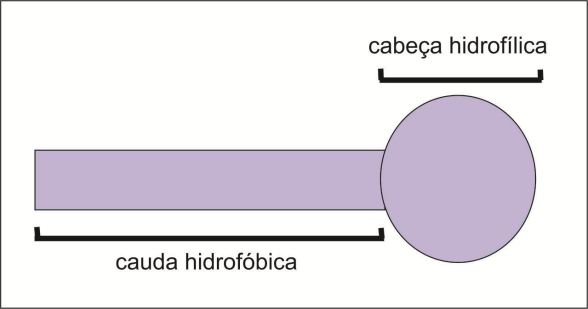
Agora, imagine o primeiro caso mostrado na figura abaixo: um copo com água e óleo, no qual é adicionado um tensoativo. De que maneira ele se comportará? A cabeça hidrofílica não gosta de óleo, então ela vai se afastar dele, permanecendo em contato com a água. E a cauda hidrofóbica, que não gosta de água, vai se afastar dela. Agora veja o segundo caso, a representação do tensoativo em um copo com água. As cabeças hidrofílicas vão se organizar de modo a proteger as caudas hidrofóbicas, evitando o contato delas com a água. No terceiro caso, em um copo de óleo, as caudas hidrofóbicas vão se organizar para proteger as cabeças hidrofílicas, evitando seu contato com o óleo.
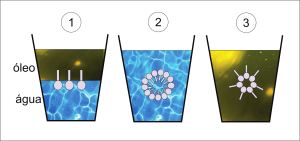
Passando essa teoria para os cabelos debaixo do chuveiro, pense que aqueles glóbulos microscópicos de óleo serão envolvidos da mesma forma como mostrado no segundo caso dessa figura, com as cabeças hidrofílicas em contato com a água do chuveiro e o óleo capturado pelo tensoativo!
Quanto maior a cabeça hidrofílica e menor a cauda hidrofóbica, mais agressivo é o tensoativo. Pela falta de equilíbrio entre essas partes, as pequenas caudas têm grande poder de se ligarem aos glóbulos microscópicos de óleo dos cabelos e serem removidas pela água. E, ao contrário, tensoativos com cabeças pequenas e caudas grandes possuem um poder mais baixo de se ligarem ao óleo, sendo, então, mais suaves.
Classificação dos tensoativos de acordo com a constituição química
Tensoativos aniônicos: possuem carga negativa, e por apresentarem valores de EHL mais altos (conceito que será explicado mais abaixo), são muito eficientes na remoção de óleo.
Exemplos: sulfatos (mais agressivos), éter sulfatos (pouco menos agressivos que os sulfatos), sulfonatos (menos agressivos), sulfosuccinatos e sarcosinatos (ambos suaves).
Tensoativos catiônicos: possuem carga positiva, atuam como emulsificantes, mas não são utilizados no mercado com finalidade de limpeza (a carga negativa dos cabelos atrai a carga positiva desses tensoativos, por isso são comuns em condicionadores ou até mesmo em shampoos, para suavizá-los). Atuam como emolientes, redutores de frizz, bactericidas e antissépticos. No co-wash, sua ação emulsificante é que contribui com a limpeza.
Exemplos: sais de amônio quaternário (cloreto de cetrimônio, cloreto de amônio, poliquaternários, metossulfato de berrentrimônio, etc…).
Tensoativos não iônicos: apresentam cauda hidrofóbica maior que cabeça hidrofílica e não possuem carga. Atuam como emulsificantes e possuem baixa capacidade de remoção de óleo. Auxiliam na solubilização do óleo em água.
Exemplos: álcoois graxos (álcool cetoestearílico, etc…), nonilfenóis etoxilados, ésteres de glicerol e de sorbitano, alcanolamidas de ácido graxo de coco, isetionatos.
Anfóteros: apresentam cauda hidrofóbica geralmente maior que cabeça hidrofílica. Possuem, na mesma molécula, cargas negativas e positivas. Por esse motivo, são agentes limpantes mais suaves que os tensoativos aniônicos, mas eficientes. Também atuam como emolientes.
Exemplos: anfóteros derivados de betaína, sultaína e imidazolina.
Estabilidade e aplicações dos tensoativos
A estabilidade das emulsões depende do equilíbrio entre as suas fases imiscíveis (água e óleo). A escolha e a proporção dos tensoativos a serem utilizados têm como base o conhecimento do equilíbrio hidrófilo-lipófilo (EHL) das misturas, que é um fator que prediz o comportamento do produto final (sua estabilidade e aplicação). As emulsões mais estáveis são aquelas que se encontram na fase dispersa, como mostra a tabela abaixo, que também apresenta as aplicações dos produtos de acordo com o EHL. Shampoos com alta concentração de sulfatos possuem EHL entre 13 e 15, por isso são mais agressivos que shampoos sem sulfatos, que costumam apresentar EHL entre 8 e 10. Valores EHL muito altos estão relacionados a substâncias que removem mais óleo dos cabelos do que o necessário, podendo danificar os cabelos.

Assim como existem emulsões com óleo disperso em água, que é quando se tem maior quantidade de água do que de óleo (caso da lavagem dos cabelos com shampoo), também existem emulsões com água dispersa em óleo. Emulsões óleo em água possuem textura leve, com espalhamento fácil e sensação não oleosa, enquanto que emulsões água em óleo apresentam espalhabilidade mais difícil, com toque mais oleoso, como alguns tipos de creme para corpo.
Tensoativos com mais de 12 carbonos em sua estrutura (por isso, terão cauda hidrofóbica mais longa) começam a ser menos agressivos que os sulfatos “clássicos”. Se compararmos o cocamidopropil betaína com o lauril sulfato de sódio, já conseguimos entender o porquê do primeiro ser o queridinho do Low Poo e, o segundo, um dos vilões. Enquanto o cocamidopropil betaína possui 19 carbonos, o lauril sulfato de sódio apresenta apenas 12. Além disso, a cabeça hidrofílica do primeiro apresenta apenas dois oxigênios, e, o segundo, quatro (cabeça maior -> afinidade com a água maior -> poder de remoção maior).
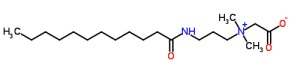
Estrutura química do cocamidopropil betaína – C19H38N2O3 (http://www.chemspider.com/)

Estrutura química do lauril sulfato de sódio – C12H25NaO4S (http://www.chemspider.com/)
Mas por que raios, então, o lauril sulfato de sódio e outros sulfatos agressivos são tão comuns em shampoos?!? Pois são mais baratos e em baixas concentrações já cumprem seus papeis, em comparação a tensoativos mais suaves.
Espero que esse conteúdo ajude no entendimento e na interpretação dos surfactantes que podem estar presentes, nos nossos cosméticos. Citei apenas alguns exemplos, mas quando surgir uma dúvida, basta procurar pelo caráter do tensoativo na internet, verificando se ele é aniônico, catiônico, não iônico ou anfótero. Buscando pela sua fórmula química, verificando a quantidade de carbonos presentes, também já dá a dica se esse tensoativo é mais agressivo ou não!
OBSERVAÇÃO: infelizmente, para bagunçar nossa cabeça, existem compostos que levam o nome de sulfato, mas não são agentes limpantes. A minha dica é sempre procurar o composto que se está em dúvida no site www.ewg.org para ver qual a sua função. O sulfato de sódio, por exemplo, é apenas um sal responsável por aumentar a viscosidade do shampoo!
Inté mais!
FONTES CONSULTADAS:
Prof. Dra. Cristina Helena Bruno (comunicação verbal).
ROBBINS, CLARENCE. Chemical and Physical Behavior of Human Hair. 5th edition, 724p. 2012.
GRIFFIN, WILLIAM. Classification of Surface-Active Agents by HLB. Journal of the Society of Cosmetic Chemists. Vol 1,p.311-326. 1949.
http://www.naturallycurly.com/curlreading/ingredients/zwitterionic-surfactants-a-milder-alternative/
http://www.naturallycurly.com/curlreading/curl-products/cleansing-agents-in-shampoos/
http://www.visaoacademica.ufpr.br/v3n1/hidrofilo.htm